Статья 47. Порядок ввоза лекарственных средств в Российскую Федерацию и вывоза лекарственных средств из Российской Федерации \ КонсультантПлюс
Статья 47. Порядок ввоза лекарственных средств в Российскую Федерацию и вывоза лекарственных средств из Российской Федерации
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
1. Ввоз лекарственных средств в Российскую Федерацию осуществляется в порядке, установленном Правительством Российской Федерации, в соответствии с таможенным законодательством Таможенного союза в рамках ЕврАзЭС (далее — Таможенный союз) и (или) законодательством Российской Федерации о таможенном деле.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
КонсультантПлюс: примечание.
До 31.12.2023 российским производителям разрешено в уведомительном порядке ввозить не внесенные в реестр фармацевтические субстанции для ветеринарного применения для производства зарегистрированных лекарственных средств (Постановление Правительства РФ от 12. 03.2022 N 353).
03.2022 N 353).
2. Ввозимые в Российскую Федерацию лекарственные средства должны содержаться в государственном реестре лекарственных средств.
(в ред. Федеральных законов от 06.12.2011 N 409-ФЗ, от 27.12.2019 N 462-ФЗ)
(см. текст в предыдущей редакции)
3. Допускается ввоз в Российскую Федерацию конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, проведения экспертизы лекарственных средств для осуществления государственной регистрации лекарственных препаратов или для оказания медицинской помощи по жизненным показаниям конкретного пациента на основании разрешения, выданного уполномоченным федеральным органом исполнительной власти по заявлениям лиц, указанных в статье 48 настоящего Федерального закона. Рассмотрение такого заявления и принятие решения о выдаче разрешения на ввоз конкретной партии зарегистрированных и (или) незарегистрированных лекарственных средств, предназначенных для проведения клинических исследований лекарственных препаратов, проведения экспертизы лекарственных средств для осуществления государственной регистрации лекарственных препаратов или для оказания медицинской помощи по жизненным показаниям конкретного пациента либо об отказе в выдаче указанного разрешения производятся в срок, не превышающий пяти рабочих дней. Плата за выдачу указанного разрешения не взимается.
Плата за выдачу указанного разрешения не взимается.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
КонсультантПлюс: примечание.
С 01.01.2024 ч. 3.1 ст. 47 утрачивает силу (ФЗ от 27.12.2019 N 475-ФЗ).
3.1. Допускается ввоз в Российскую Федерацию конкретной партии незарегистрированных лекарственных препаратов, содержащих наркотические средства или психотропные вещества, в порядке, установленном Правительством Российской Федерации, для оказания медицинской помощи по жизненным показаниям конкретного пациента или группы пациентов в случае, если имеется решение врачебной комиссии медицинской организации о неэффективности или невозможности применения у конкретного пациента иных зарегистрированных лекарственных препаратов, в том числе содержащих другие действующие вещества, и о необходимости ввоза определенного незарегистрированного лекарственного препарата с указанием его международного непатентованного (или химического, или группировочного) наименования, формы выпуска и количества. Перечень заболеваний и состояний и соответствующих лекарственных препаратов, содержащих наркотические средства и психотропные вещества, в целях осуществления их ввоза в соответствии с требованиями настоящей части утверждается уполномоченным федеральным органом исполнительной власти.
Перечень заболеваний и состояний и соответствующих лекарственных препаратов, содержащих наркотические средства и психотропные вещества, в целях осуществления их ввоза в соответствии с требованиями настоящей части утверждается уполномоченным федеральным органом исполнительной власти.
(часть 3.1 введена Федеральным законом от 27.12.2019 N 475-ФЗ)
3.2. До 31 декабря 2024 года допускаются ввоз на территорию Российской Федерации и обращение в Российской Федерации с учетом особенностей, установленных Правительством Российской Федерации, зарегистрированных лекарственных препаратов для медицинского применения в упаковках, предназначенных для обращения в иностранных государствах, в случае дефектуры лекарственных препаратов или риска ее возникновения в связи с введением в отношении Российской Федерации ограничительных мер экономического характера при условии соответствия ввозимых лекарственных препаратов требованиям, установленным при их регистрации, за исключением требований к первичной упаковке, вторичной (потребительской) упаковке, а также при наличии на вторичной (потребительской) упаковке лекарственных препаратов, находящихся в обращении, самоклеящейся этикетки, содержащей информацию о лекарственном препарате на русском языке.
(часть 3.2 введена Федеральным законом от 26.03.2022 N 64-ФЗ; в ред. Федерального закона от 19.12.2022 N 519-ФЗ)
(см. текст в предыдущей редакции)
4. В Российскую Федерацию можно ввозить лекарственные средства, качество которых подтверждено сертификатом производителя лекарственных средств, удостоверяющим соответствие ввозимых лекарственных средств требованиям фармакопейных статей либо в случае их отсутствия нормативной документации или нормативного документа.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
5. Запрещается ввоз в Российскую Федерацию фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
6. Фальсифицированные лекарственные средства, недоброкачественные лекарственные средства подлежат изъятию и последующему уничтожению или вывозу из Российской Федерации, контрафактные лекарственные средства — изъятию и последующему уничтожению. Уничтожение или вывоз из Российской Федерации фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств осуществляется за счет лица, осуществившего их ввоз. Порядок уничтожения изъятых фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств устанавливается Правительством Российской Федерации.
Уничтожение или вывоз из Российской Федерации фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств осуществляется за счет лица, осуществившего их ввоз. Порядок уничтожения изъятых фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств устанавливается Правительством Российской Федерации.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
7. Лица, осуществляющие ввоз в Российскую Федерацию фальсифицированных лекарственных средств, недоброкачественных лекарственных средств, контрафактных лекарственных средств, несут ответственность в соответствии с таможенным законодательством Таможенного союза и (или) законодательством Российской Федерации о таможенном деле.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
8. Вывоз лекарственных средств из Российской Федерации осуществляется без применения ограничений, установленных таможенным законодательством Таможенного союза и (или) законодательством Российской Федерации о государственном регулировании внешнеторговой деятельности.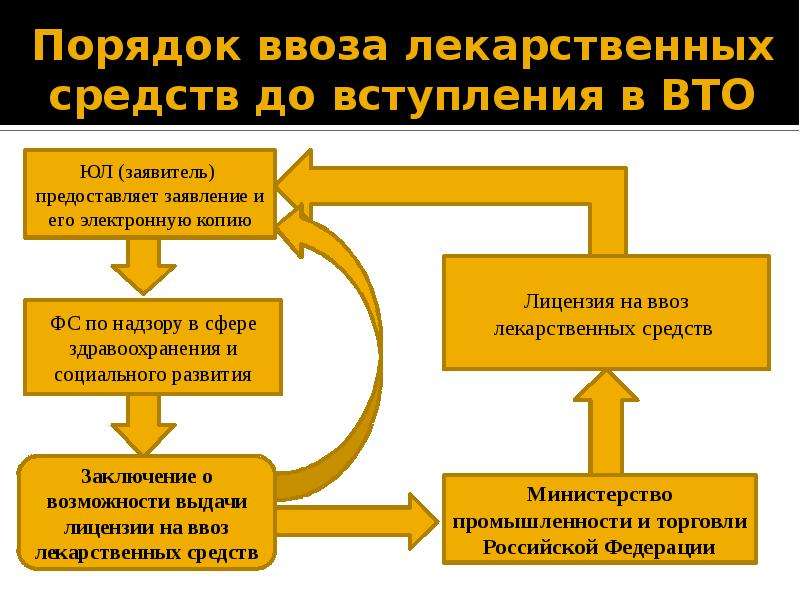
(в ред. Федеральных законов от 06.12.2011 N 409-ФЗ, от 25.11.2013 N 317-ФЗ, от 22.12.2014 N 429-ФЗ)
(см. текст в предыдущей редакции)
9. Ввод в гражданский оборот лекарственных препаратов для медицинского применения, ввезенных в Российскую Федерацию, осуществляется с соблюдением требований, установленных статьей 52.1 настоящего Федерального закона.
(часть 9 введена Федеральным законом от 28.11.2018 N 449-ФЗ)
Статья 50. Ввоз лекарственных препаратов в Российскую Федерацию для личного использования и иных некоммерческих целей, а также для использования на территории международного медицинского кластера \ КонсультантПлюс
Подготовлена редакция документа с изменениями, не вступившими в силу
Статья 50. Ввоз лекарственных препаратов в Российскую Федерацию для личного использования и иных некоммерческих целей, а также для использования на территории международного медицинского кластера
(в ред. Федеральных законов от 06.12.2011 N 409-ФЗ, от 29.06. 2015 N 160-ФЗ)
2015 N 160-ФЗ)
(см. текст в предыдущей редакции)
1. Лекарственные препараты могут быть ввезены в Российскую Федерацию без учета требований, предусмотренных частями 1 — 4 статьи 47, статьями 48 и 49 настоящего Федерального закона, если они предназначены для:
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
1) личного использования физическими лицами, прибывшими в Российскую Федерацию. При этом ввоз в Российскую Федерацию лекарственных препаратов, содержащих сильнодействующие и (или) ядовитые вещества, включенные соответственно в список сильнодействующих веществ для целей уголовного законодательства Российской Федерации и в список ядовитых веществ для целей уголовного законодательства Российской Федерации, утвержденные Правительством Российской Федерации, осуществляется при наличии документов (заверенных копий документов или заверенных выписок из них), подтверждающих назначение физическому лицу указанных лекарственных препаратов (за исключением лекарственных препаратов, зарегистрированных в Российской Федерации и отпускаемых в Российской Федерации без рецепта на лекарственный препарат). Подтверждающие документы (их заверенные копии или заверенные выписки из них) должны содержать сведения о наименовании и количестве назначенного лекарственного препарата. В случае, если подтверждающие документы (их заверенные копии или заверенные выписки из них) составлены на иностранном языке, к ним прилагается нотариально заверенный перевод на русский язык;
Подтверждающие документы (их заверенные копии или заверенные выписки из них) должны содержать сведения о наименовании и количестве назначенного лекарственного препарата. В случае, если подтверждающие документы (их заверенные копии или заверенные выписки из них) составлены на иностранном языке, к ним прилагается нотариально заверенный перевод на русский язык;
(п. 1 в ред. Федерального закона от 02.06.2016 N 163-ФЗ)
(см. текст в предыдущей редакции)
2) использования работниками дипломатического корпуса или представителями международных организаций, аккредитованных в Российской Федерации;
3) лечения пассажиров и членов экипажей транспортных средств, поездных бригад и водителей транспортных средств, прибывших в Российскую Федерацию;
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
4) лечения участников международных культурных, спортивных мероприятий и участников международных экспедиций;
5) лечения конкретных животных в зоопарках, зоосадах, цирках, океанариумах, дельфинариях, лечения диких животных, постоянно или временно населяющих территорию Российской Федерации, находящихся в состоянии естественной свободы и принадлежащих к видам, занесенным в Красную книгу Российской Федерации и (или) красные книги субъектов Российской Федерации, а также животных, ввозимых в Российскую Федерацию для участия в спортивных и зрелищных мероприятиях;
(в ред. Федеральных законов от 06.12.2011 N 409-ФЗ, от 02.08.2019 N 297-ФЗ)
Федеральных законов от 06.12.2011 N 409-ФЗ, от 02.08.2019 N 297-ФЗ)
(см. текст в предыдущей редакции)
6) использования на территории международного медицинского кластера.
(п. 6 введен Федеральным законом от 29.06.2015 N 160-ФЗ)
2. В случаях, предусмотренных частью 1 настоящей статьи, допускается ввоз в Российскую Федерацию лекарственных препаратов, не зарегистрированных в Российской Федерации.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
3. Лекарственные препараты, предназначенные для гуманитарной помощи (содействия) или помощи при чрезвычайных ситуациях, ввозятся в Российскую Федерацию в порядке, установленном Правительством Российской Федерации. Запрещается ввоз в Российскую Федерацию незарегистрированных лекарственных препаратов, предназначенных для гуманитарной помощи (содействия) или помощи при чрезвычайных ситуациях.
(в ред. Федерального закона от 06.12.2011 N 409-ФЗ)
(см. текст в предыдущей редакции)
Ввоз лекарственных средств
Существует ряд законодательных актов, регулирующих порядок ввоза лекарственных средств на территорию Российской Федерации: Федеральный закон от 12. 04.2010 № 61 «Об обращении лекарственных средств»; Постановление Правительства РФ от 29.09.2010 № 771 «О порядке ввоза лекарственных средств для медицинского применения на территорию Российской Федерации»; Соглашение от 18.06.2010 «О порядке перемещения товаров физическими лицами для личного пользования через таможенную границу Таможенного союза и совершения таможенных операций, связанных с их выпуском».
04.2010 № 61 «Об обращении лекарственных средств»; Постановление Правительства РФ от 29.09.2010 № 771 «О порядке ввоза лекарственных средств для медицинского применения на территорию Российской Федерации»; Соглашение от 18.06.2010 «О порядке перемещения товаров физическими лицами для личного пользования через таможенную границу Таможенного союза и совершения таможенных операций, связанных с их выпуском».
Ввоз лекарственных средств для коммерческих целей
По общему правилу ввозимые на территорию Российской Федерации лекарственные средства подлежат включению в реестр лекарственных средств. При ввозе лекарственных средств, предназначенных для клинических исследований, экспертизы для государственной регистрации или для оказания медицинской помощи конкретному пациенту, необходимо получить специальное разрешение Минздрава РФ. Лекарственные средства должны быть сертифицированы производителем, подтверждающим их соответствие требованиям фармакопейных статей или нормативных документов или правил.
Для ввоза препарата индивидуальному пациенту необходимо, помимо основных документов, обеспечить проведение консультации. Этот документ должен быть оформлен в организации, оказывающей медицинскую помощь больному. Помимо заключения необходимо предоставить заявление уполномоченного органа субъекта Российской Федерации, подтверждающее необходимость ввоза данного лекарственного средства пациенту. Также необходимо приложить заверенную копию документа, удостоверяющего личность пациента.
Во всех случаях Минздрав обязан рассмотреть заявление о выдаче разрешения в срок не более 5 рабочих дней. Закон установил только два основания, по которым Минздрав может отказать в выдаче разрешения: наличие неполных или недостоверных сведений в документах; запрет медицинского применения препарата на территории Евразийского Таможенного союза.
Заявление о выдаче разрешения регистрируется в специальном реестре выданных разрешений, который ведется Министерством здравоохранения Российской Федерации.
Ввоз поддельных, недоброкачественных или контрафактных лекарств запрещен, и этот запрет распространяется и на физических лиц.
Лекарственные средства могут ввозиться:
1) производителями для собственного производства лекарственных средств;
2) иностранные разработчики и производители лекарственных средств или иные юридические лица по поручению разработчика для проведения клинических исследований, государственной регистрации, включения фармацевтической субстанции в государственный реестр, контроля качества лекарственных средств с разрешения Министерства Здоровье на ввоз той или иной партии лекарств;
3) оптовая фармацевтическая компания;
4) научно-исследовательские и образовательные организации, производители лекарственных средств для разработки, исследований, контроля безопасности, контроля качества, контроля эффективности с разрешения Министерства здравоохранения;
5) организации здравоохранения и иные организации, оказывающие медицинскую помощь по показаниям для спасения жизни конкретного больного с разрешения Министерства здравоохранения.
Ввоз лекарственных средств для личного пользования и других некоммерческих целей
Лекарственные препараты могут ввозиться в Россию без разрешения Минздрава и иных требований, предъявляемых к юридическим лицам, и без регистрации, если они предназначены для:
1) личного применения физическими лицами, прибывшими на территорию Российской Федерации ;
2) использование работников дипломатического корпуса и представителей международных организаций, аккредитованных в Российской Федерации;
3) обслуживание пассажиров и членов экипажей транспортных средств, поездных бригад и водителей транспортных средств, прибывающих в Российскую Федерацию;
4) лечение участников международных культурных и спортивных мероприятий и участников международных миссий;
5) обращение со специфическими животными в зоопарках, а также с животными, ввозимыми в Российскую Федерацию для участия в спортивно-зрелищных мероприятиях;
6) использование в международном медицинском кластере.
Необходимо учитывать, что с июня 2016 г. действует новая норма Федерального закона № 61, ограничивающая ввоз сильнодействующих и (или) ядовитых веществ, которая, однако, не вошла в правила ввоза лекарственных средств, утвержденные Правительство Российской Федерации. Физическое лицо должно быть готово предоставить заверенные копии документов или заверенные выписки из них, подтверждающие назначение импортных лекарственных средств. Фактически этот документ является рецептом, хотя прямого названия документа в законодательстве нет. Документ должен содержать информацию о наименовании и номере назначаемого лекарственного средства. Документы, составленные на иностранном языке, должны быть переведены на русский язык и нотариально заверены. Правило не распространяется на лекарственные средства, зарегистрированные в Российской Федерации и отпускаемые без рецепта. Перечень этих препаратов можно найти в перечне сильнодействующих веществ и перечне ядовитых веществ, утвержденных Постановлением Правительства от 29 декабря. , 2007 № 964.
, 2007 № 964.
Подобный запрет давно существует в странах ЕС, где также действуют ограничения на ввоз лекарственных средств. Поскольку наркотики являются вирулентными, у таможенных и пограничных органов часто возникают вопросы о том, с какой целью ввозится тот или иной наркотик. Ведь, возможно, человек перевозит наркотики через границу не для лечения, а для других целей: перепродажи, получения наркотического воздействия. По сути, установление этой нормы не должно коснуться большинства людей, ввозящих наркотики. Однако лучше обратить внимание на состав ввозимого препарата на наличие сильнодействующих и ядовитых веществ.
Незаконный провоз сильнодействующих и ядовитых веществ через границу Таможенного союза теперь приравнивается к контрабанде. Согласно статье 226.1 УК РФ данное преступление предусматривает наказание за перевозку таких лекарственных средств для физических лиц в виде лишения свободы на срок от трех до семи лет или штраф в размере до 1 млн рублей.
Мария Никитина, младший юрист Юридической фирмы BRACE
Законодательное регулирование импорта лекарственных средств
В отношении лекарственных средств применяются унифицированные методы нетарифного регулирования, предусматривающие разрешительную систему их ввоза и вывоза с таможенной территории ЕАЭС. Россия внимательно следит за этим.
Россия внимательно следит за этим.
По общему правилу разрешен ввоз в Евразийскую экономическую зону лекарственных средств, включенных в Единый реестр зарегистрированных лекарственных средств ЕАЭС или в соответствующий реестр государства-члена. Но при ввозе необходимо соблюдать особые требования, которые вводит каждая страна, входящая в ЕАЭС. Также следует учитывать, что деятельность, связанная с обращением лекарственных средств, относится к лицензируемым видам деятельности, а выбор дистрибьюторов и заказчиков регулируется строгими правилами.
Порядок ввоза лекарственных средств на примере России
Выдача лицензий в РФ связана с рядом ограничений при выборе дистрибьюторов и заказчиков. Таким образом, только юридическое лицо, имеющее специальную лицензию, может выступать в качестве импортера в России коммерческой партии лекарств. Кроме того, транспортировку и хранение лекарственных средств должны осуществлять организации, имеющие необходимые разрешения и квалифицированный персонал. При ввозе лекарственных средств в Россию необходимо соблюдать требования, предусмотренные Постановлением Правительства РФ № 771 от 29 сентября., 2010. В соответствии с ними ввоз лекарственных средств в Россию могут осуществлять следующие юридические лица:
При ввозе лекарственных средств в Россию необходимо соблюдать требования, предусмотренные Постановлением Правительства РФ № 771 от 29 сентября., 2010. В соответствии с ними ввоз лекарственных средств в Россию могут осуществлять следующие юридические лица:
- производители лекарственных средств для собственного производства,
- оптовые организации, иностранные разработчики и производители лекарственных средств или иные уполномоченные разработчиками юридические лица — для проведения клинических исследований, регистрации и контроля качества,
- научных и образовательных организаций высшего образования и производителей лекарственных средств – за разработку, исследования, контроль безопасности, качества и эффективности лекарственных средств,
- медицинских и иных организаций, перечисленных выше, для оказания медицинской помощи по жизненным показаниям конкретного больного.
В некоторых случаях для ввоза определенной партии лекарств требуется разрешение Минздрава, которое оформляется в электронном виде и подписывается ЭЦП. Заявление о таком разрешении и результаты решения заносятся в специальный реестр Минздрава. На практике срок получения такого разрешения, как правило, не превышает пяти рабочих дней. В заявлении на получение разрешения необходимо указать следующую информацию:
Заявление о таком разрешении и результаты решения заносятся в специальный реестр Минздрава. На практике срок получения такого разрешения, как правило, не превышает пяти рабочих дней. В заявлении на получение разрешения необходимо указать следующую информацию:
- название лекарства,
- лекарственная форма,
- доза, концентрация, упаковка,
- наименование организации – производителя лекарственного средства,
- страна производителя лекарства.
Кроме того, в зависимости от цели ввоза лекарств необходимо предоставить ряд документов. К ним относятся, в частности:
- копии учредительных и регистрационных документов заявителя,
- сертификат качества ввозимых лекарственных средств,
- разрешение Минздрава на проведение клинического исследования,
- заключение консилиума врачей о необходимости применения незарегистрированного лекарственного средства по жизненным показаниям,
- экземпляров документов, подтверждающих надлежащую маркировку для использования лекарственных средств в клинических исследованиях.

При этом в ряде случаев возможен ввоз лекарственных средств без получения разрешения Минздрава РФ, а именно в следующих целях:
- личное использование лекарственных средств физическими лицами,
- использование лекарственных средств сотрудниками дипломатического корпуса или представителями международных организаций, аккредитованными в Российской Федерации,
- обращение с транзитными пассажирами и членами экипажа,
- лечение участников международных культурно-спортивных мероприятий и участников международных экспедиций.
Кроме того, российское законодательство содержит специальные правила, регулирующие порядок выпуска в обращение лекарственных средств для медицинского применения. Обязательная сертификация и декларирование соответствия в отношении лекарственных средств заменены правилами получения протокола испытаний первых трех серий или партий лекарственных средств, ввозимых в Россию впервые. Этот отчет подтверждает соответствие импортных лекарственных средств нормативным требованиям. Для выпуска в обращение каждой партии или серии иммунобиологических препаратов требуется специальное разрешение Росздравнадзора.
Для выпуска в обращение каждой партии или серии иммунобиологических препаратов требуется специальное разрешение Росздравнадзора.
Вся необходимая информация о лекарственных средствах, выпущенных в обращение, должна быть занесена в специальную автоматизированную информационную систему. Хотя эти обязанности возложены на российских импортеров, а не на иностранных производителей, последние все же заинтересованы в своевременном предоставлении своим партнерам необходимых образцов и документов, чтобы производимые ими лекарственные средства могли беспрепятственно пускаться в обращение на территории России. .
Следующее крупное изменение произойдет 01.07.2020.
В середине года вступит в силу очередное ужесточающее требование. С 01.07.2020 все лекарственные препараты, предназначенные для российского рынка, должны быть маркированы цифровым кодом. Такой уникальный код DataMatrix для каждого продукта обеспечит защиту от подделки и позволит отслеживать движение лекарств от производителя до конечного потребителя.


Leave a Reply