Инструкции и файлы форм для PHS 398
Все заметные изменения, внесенные в инструкции и страницы форм PHS 398, перечислены внизу
этой страницы (обновлено 16.03.2021).
Загружаемые инструкции и файлы форм
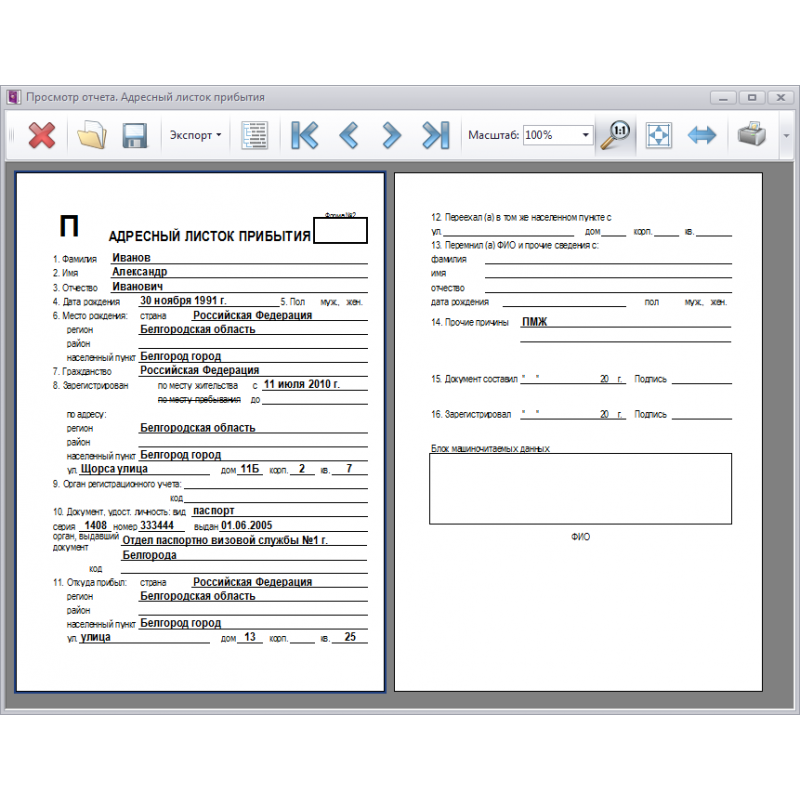
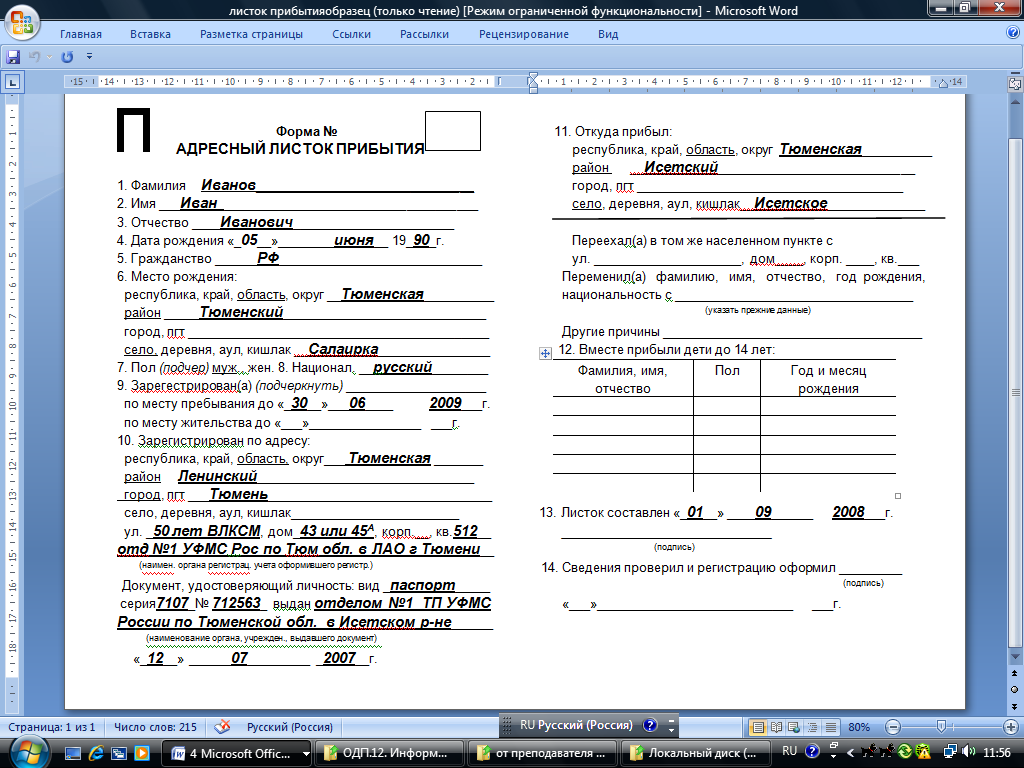
Инструкции PHS 398 — редакция 3/2020 PDF (454 КБ)
Заполняемые формы PHS 398 — редакция 3/2020
90 002 Приведенные ниже ссылки позволяют загружать отдельные и комбинированные файлы форм. в форматах MS Word и PDF. Некоторые файлы имеют большой размер, и их загрузка может занять несколько минут.
| Заполняемые индивидуальные формы PHS 398 (эти формы должны использоваться только при подаче бумажных документов с использованием PHS 398. Используйте ли , а не образцы PDF, приведенные ниже в приложении SF424 (R&R). Это заполняемые формы PDF, которые приведет к ошибке при электронной подаче заявки SF424 (R&R). | ||
|---|---|---|
| Форма Страница 1: Лицевая страница | MS Word | PDF (414 КБ) |
| Форма Страница 1-продолжение: Дополнительная форма для использования только , если предлагается несколько PD/PI. Включайте вместо при подаче заявления с одним PD/PI. | MS Word | PDF (434 КБ) |
| Страница формы 2: Резюме, релевантность, места проведения проектов/выступлений, старший/ключевой персонал, другие важные участники и эмбриональные стволовые клетки человека | MS Word | PDF (565 КБ) |
| Страница формата сайта проекта/представления — используйте только в том случае, если требуется дополнительное пространство. | MS Word | PDF (282 КБ) |
| Страница формы 3: Исследовательский грант Содержание | MS Word | PDF (273 КБ) |
| Страница формы 4: Подробный бюджет на начальный бюджетный период | MS Word | PDF (210 КБ) |
| Страница формы 5: Бюджет на весь предлагаемый период проекта | MS Word | PDF (342 КБ) |
| Страница формата ресурсов | MS Word | PDF (281 КБ) |
| Форма контрольного списка | MS Word | PDF (528 КБ) |
| Продолжение страницы формата | MS Word | PDF (224 КБ) |
| PHS Информация о людях и клинических испытаниях | PDF (118 КБ) | |
| Почтовый адрес | MS Word | PDF (27 КБ) |
| Формат отчета всего персонала Страница | MS Word | PDF (281 КБ) |
| Комбинированный файл форм PHS 398 НЕ включает страницу биографического очерка, страницу продолжения или любую из страниц с образцами/примерами (образец Biosketch, образец другой поддержки). | Комбинированные файлы форм PHS 398 (MS Word) | Комбинированные файлы форм PHS 398 (PDF) (659КБ) |
Другая поддержка: см. http://grants.nih.gov/grants/forms/othersupport.htm
Biosketches: см. http://grants.nih.gov/grants/forms/biosketch.htm
Часто задаваемые вопросы о биоскетчах
По вопросам, касающимся:
- Процедуры подачи заявок/форм: , свяжитесь с GrantsInfo по адресу [email protected]
или 301-945-7573.
Примечание. Другие программные пакеты для выполнения этих приложений могут
быть доступным из других источников; однако важно, чтобы спецификации размера шрифта и формата
которые встретились. В противном случае обработка заявки может затянуться, либо заявка может быть возвращена в
заявителя без рассмотрения.
Отказ от ответственности: Ссылка на эти программные пакеты не является
и не следует рассматривать как одобрение или рекомендацию какого-либо продукта, услуги или предприятия.
Национальными институтами здравоохранения, любым другим агентством правительства Соединенных Штатов или любым сотрудником
правительства Соединенных Штатов. Никакие гарантии не заявлены и не подразумеваются.
Заметные изменения, внесенные в PHS 398
03/2021
Форма Страница 4: Подробный бюджет на начальный бюджетный период
- Исправлено поле Строка 7 Итого в разделе Персонал; это редактируемое поле формы.
03/2020
Обновлен срок действия OMB до 28.02.2023.
PHS Информационная форма для субъектов и клинических испытаний
- В организацию формы были внесены изменения в следующих разделах:
- Кому следует использовать форму PHS «Информация о людях и клинических испытаниях»
- Использование формы
- Использование человеческих образцов и/или данных
- Уточненные и обновленные инструкции.
 Значительные изменения были внесены для следующих полей:
Значительные изменения были внесены для следующих полей: - «Укажите идентификатор ClinicalTrials.gov»
- «Раздел 2 — Характеристики исследуемой совокупности» теперь отражают обновленные исключения для обязательных вопросов.
- Хронология исследования
- Раздел 3.2: «Является ли это многоцентровым исследованием, в котором будет использоваться один и тот же протокол для проведения исследований на людях, не подпадающих под исключение, более чем в одном национальном исследовании?» — отражать обновленные инструкции.
- Приложение «План мониторинга данных и безопасности»
- Обновленные инструкции для исследований с отсроченным началом в отношении использования одного IRB.
- Добавлено новое вложение «Включение лиц на протяжении всей жизни».
- Обновлены инструкции для приложения «Включение женщин и меньшинств», чтобы отразить отдельное приложение «Включение людей на протяжении всей жизни».
- Добавлено новое поле «Заголовок отчета о включении регистрации».
- Удалено поле «Краткая сводка».
- Изменено поле «Повествование» на «Подробное описание».
- Обновлены инструкции к разделу 3.2 «Является ли это многоцентровым исследованием, в котором будет использоваться один и тот же протокол для проведения исследований на людях, не подпадающих под исключения, более чем в одном национальном исследовательском центре?» и приложение к единому плану IRB. Включены инструкции для заявителей AHRQ.
- Включены инструкции для заявителей AHRQ к разделу 3.3 «План мониторинга данных и безопасности».
- Добавлено новое «Является ли это применимым клиническим испытанием в соответствии с FDAAA?» поле.
- Перенумерованы поля формы.
информации о людях и клинических испытаниях PHS
Инструкции
25.01.2018
Биографический очерк
- Обновлены инструкции по биозарисовкам, так что для успеваемости требуется указывать только научные/профессиональные курсы для выпускников
План исследования
- Отчет о включении PHS: прекращенное использование (сбор данных перемещен в новую форму PHS «Информация о людях и клинических испытаниях»)
Форма информации о людях и клинических испытаниях PHS
- Существует новая форма для объединенных субъектов-людей, включения отчета о регистрации и информации о клинических испытаниях.

- Включает в себя приложение для соблюдения Политики NIH по использованию единого институционального наблюдательного совета для многоцентровых исследований.
- Включает обновленную политику приложений, исключающую материалы, связанные с клиническими испытаниями. Дополнительную информацию см. в Руководстве NIH по разрешенным материалам приложений.
Перейти
на страницу форм и приложений NIH
Создание веб-формы
Поиск
Создание веб-формы
На главной странице нажмите Опубликовать веб-форму
Примечание:
Если вы находитесь в учетной записи, в которой включены пользователи в нескольких группах (UMG), перед настройкой выберите группу, к которой вы хотите связать веб-форму.
- Установка значения Group загружает связанные с группой свойства и шаблоны для выбора.

- При изменении группы вы заметите обновление страницы. Любое введенное содержимое будет удалено при этом обновлении.
Если вы не видите раскрывающегося списка Отправить с в верхней части страницы, ваша учетная запись не включена в UMG.
Введите имя веб-формы
- Если вы добавите файл без предварительной настройки имени веб-формы, веб-форма примет имя файла.
- Вы можете редактировать имя веб-формы, только если она находится в статусе Draft . После создания веб-формы значение имени блокируется.
- Установка значения Group загружает связанные с группой свойства и шаблоны для выбора.
Настройка взаимодействия для первого участника:
(первый участник — это человек, который первоначально взаимодействует с веб-формой. В случае, когда разрешено несколько участников, первый участник предоставляет адреса электронной почты для всех последующих участников.)
- Роль участника:
- Подписавший — Подписывающие должны поставить подпись в дополнение к любым другим обязательным полям
- Утверждающий — Утверждающие могут заполнять поля, но не обязаны применять подпись
- Принимающий — Принимающие лица, как и утверждающие, могут заполнять содержимое поля, но не обязаны предоставлять подпись
- Заполнитель форм — Заполнители форм могут только заполнять поля, и к ним не может быть применено поле подписи
- Аутентификация:
- Нет — этот параметр использует только подтверждение электронной почты после отправки веб-формы (если это настроено)
- Пароль – параметр пароля требует, чтобы получатель ввел пароль перед просмотром документа
- Аутентификация на основе знаний (KBA) – KBA можно включить в качестве метода аутентификации, если ваша учетная запись настроена на разрешение неограниченных транзакций KBA.
 Имейте в виду, что KBA действителен только в США
Имейте в виду, что KBA действителен только в США
.
Примечание:
Проверка подлинности Acrobat Sign и Правительственный идентификатор не поддерживаются для проверки подлинности веб-форм.
- Роль участника:
(необязательно, если включено) Добавить участника
Щелчок по ссылке Добавить участника добавляет в веб-форму дополнительного участника.
- Дополнительные участники определяются первым участником, который должен указать все адреса электронной почты для последующих участников.
- Для первого участника могут быть предоставлены инструкции о том, как и когда добавлять дополнительных участников.
- Дополнительные участники могут быть необязательными или обязательными.
- Добавить участник — Ссылка Добавить участник позволяет добавить одного или нескольких последующих участников (участник 2, участник 3 и т.
 Д. ссылка добавляет на страницу одну строку участника (до 25).
Д. ссылка добавляет на страницу одну строку участника (до 25). - Дополнительные участники могут быть необязательными или обязательными:
- Если необязательно, участнику 1 предлагается назначить следующего участника. Если новый участник не идентифицирован, поток подписи переходит к контрподписавшим (если есть) 90 157.
- При необходимости Участник 1 должен указать имя и адрес электронной почты, чтобы Участник 2 мог продолжить выполнение соглашения. Если они этого не сделают, соглашение остановится на этом этапе.
- Дополнительных участников можно настроить только для использования методов аутентификации Email и KBA .
- Участник 2 настроен так же, как и Участник 1
- Участник 2 имеет две дополнительные роли, которые можно назначить: Сертифицированный получатель и Делегатор.
- Дополнительные участники определяются первым участником, который должен указать все адреса электронной почты для последующих участников.
- Участнику 1 будет предложено указать имя и адрес электронной почты Участника 2
- Добавление Участника 2 позволяет добавить Участника 3 и так далее.
 ..
..
- Добавление Участника 2 позволяет добавить Участника 3 и так далее.
- Если включен Участник 2, Участник 1 должен сначала подтвердить свой адрес электронной почты, прежде чем система уведомит Участника 2.
Добавьте контрподписавших и сторон с копиями.
Если вы хотите, чтобы ваша веб-форма была подписана:
- Введите адреса электронной почты сторон, которым вы хотите подписать или утвердить соглашение, в разделе Стороны, подписавшие соглашение:
- Вы можете указать себя (создателя веб-формы), нажав ссылку «Добавить меня » справа. .
- Настройте соответствующую роль для каждого получателя. Будут доступны все роли, включенные администратором.
- Определите правильный метод проверки подлинности для каждой стороны, подписывающей.
- Чтобы соглашение было завершено, все определенные стороны, подписавшие его, должны поставить свою подпись/утверждение в том порядке, в котором вы указали их.
- Электронные письма лиц, подписывающих контрагенты, можно редактировать после отправки соглашения на странице Управление (только для службы корпоративного уровня).

- Вы можете редактировать только адрес электронной почты контрподписавшего. Вы не можете добавить или уменьшить количество контрподписавших.
Добавьте участников с копиями, щелкнув ссылку Показать CC .
- Введите адрес(а) электронной почты, которые вы хотите автоматически включать в электронные письма о завершении соглашения.
- Электронные сообщения CC можно редактировать после отправки соглашения на странице «Управление » (только для службы корпоративного уровня).
- Вы можете редактировать только адреса электронной почты сторон, на которые подписаны копии. Вы не можете добавить или уменьшить количество CC.
- Электронные сообщения CC можно редактировать после отправки соглашения на странице «Управление » (только для службы корпоративного уровня).
Примечание:
Имейте в виду, что контрподписавшие всегда будут последними подписавшимися. Процесс всегда начинается с человека, который посещает веб-форму.
- Введите адреса электронной почты сторон, которым вы хотите подписать или утвердить соглашение, в разделе Стороны, подписавшие соглашение:
Перетащите файлы, которые вы хотите использовать в качестве основы для веб-формы, в раздел Файлы или нажмите Добавить файлы и перейдите к документу на любом сетевом диске или во встроенном хранилище файлов.

Примечание:
Существующие шаблоны библиотеки также можно импортировать (с неповрежденными авторскими полями).
Настройка Параметры
- Защита паролем . Если вы хотите применить пароль для открытия окончательного PDF-файла, созданного путем подписания веб-формы, установите этот флажок. Вам будет предложено ввести пароль.
- Язык получателя (только уровни обслуживания Business и Enterprise) — этот параметр определяет язык, используемый для экранных инструкций, а также уведомлений по электронной почте, связанных с веб-формой
Установите флажок Предварительный просмотр и добавление полей подписи и нажмите Далее .
Страница обновится и отобразит загруженные файлы в среде разработки.
Перетащите необходимые поля с правой стороны страницы на документ по мере необходимости.

Убедитесь, что вы разместили по крайней мере одну подпись для каждого подписавшегося, включая первых участников и всех подписавшихся против вас.
Поля электронной почты необязательны, но если в самой форме нет поля, Adobe Acrobat Sign предложит участнику указать адрес электронной почты. Во всех случаях для каждого участника должен быть указан адрес электронной почты.
После размещения всех полей нажмите кнопку Сохранить в правом нижнем углу. Сохранение документа на этом этапе запустит веб-форму как активный общедоступный URL-адрес.
Примечание:
Если выйти из окна разработки без сохранения, веб-форма будет сохранена как Черновик на странице Управление
Тревога:
Цифровые подписи не поддерживаются и не должны добавляться.
Вы перейдете на страницу после создания веб-формы.
Когда Участник 1 выполнит необходимые действия и нажмет Отправить , ему будет предложено Назначить следующего участника:

 Подходящие форматы для электронной подачи см. в руководстве по подаче заявки.
Подходящие форматы для электронной подачи см. в руководстве по подаче заявки. См. Ссылки на файлы отдельных форм выше.
См. Ссылки на файлы отдельных форм выше.
Leave a Reply